Физик Фарадэй в 1825 году выделил из светильного газа неизвестную жидкость, замерзающую при температуре 50С, кипящую при температуре 500С. Он установил, что это вещество состоит из атомов углерода и водорода и назвал его карбюрированным углеродом.

Химик Черлих получил это вещество из бензойной кислоты и установил его формулу. А химик Либих дал название этому веществу – бензол.

Бензол представляет собой особую группу веществ, принадлежащих к ароматическим углеводородам.
Структурная формула простейшего представителя ароматических углеводородов – бензола – была впервые предложена немецким химиком Кекуле. Кекуле является также одним из создателей теории химического строения органических соединений. Название «ароматические» эти соединения получили потому, что впервые выделенные из природных смесей ароматические соединения имели характерный приятный запах (от греческого арома – запах).

Молекулярная формула бензола С6Н6. На шесть атомов углерода в молекуле бензола приходится только шесть атомов водорода. Эти С – С связи в молекуле бензола ненасыщенные. Однако доказано, что бензол в обычных условиях не вступает в реакции присоединения, характерные для ненасыщенных углеводородов.

Получаются противоречия между структурной формулой бензола с двойными связями и его химическими свойствами. Поэтому молекула бензола изображается различными способами.
При изображении структурных формул бензола не всегда указываются атомы углерода или атомы углерода и водорода. Могут быть показаны три двойные связи внутри цикла или просто рисуют круг.
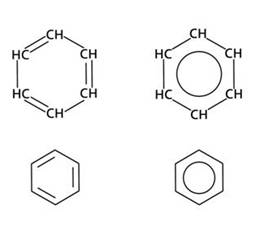
оказано, что молекула бензола имеет плоскостное строение – все двенадцать атомов молекулы расположены в одной плоскости. Общая формула ароматических углеводородов – CnH2n-6.
Бензол – прозрачная жидкость с характерным запахом. Относится к очень ядовитым соединениям, обладающим канцерогенными свойствами.
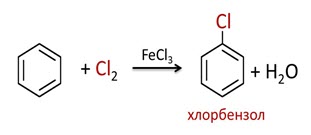
В отличие от ненасыщенных соединений, для которых характерны реакции присоединения, для бензола характерны реакции замещения. Например, бензол вступает в химическую реакцию с бромом (или хлором) в присутствии катализатора.
В реакции с хлором один из атомов водорода в молекуле бензола замещается на атом хлора с образованием другого ароматического соединения – хлорбензола.
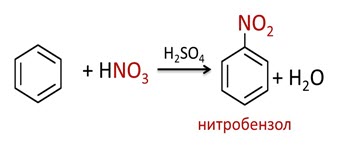
В присутствии нитрирующей смеси (азотной и концентрированной серной кислоты) в бензоле также замещается атом водорода на нитрогруппу и образуется нитробензол.
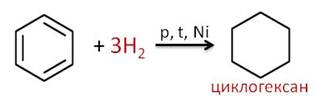
Менее характерны для бензола реакции присоединения. Например, в реакции присоединения три моль водорода к бензолу образуется циклогексан.
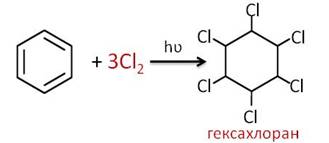
При присоединении три моль хлора к бензолу в присутствии света образуется гексахлоран.
Бензол, как и все углеводороды горит с образованием углекислого газа и воды.
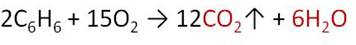
Бензол и его гомологи широко используются в промышленности для синтеза красителей, взрывчатых и душистых веществ, для получение пластмассы, фенола, их используют как растворители.

Ароматические соединения присутствуют и в пережаренном цыплёнке, табачном дыму, печной саже и выхлопных газах дизельных двигателей. Это такие соединения, как пирен и бензопирен, которые так же, как и бензол, обладают канцерогенными свойствами.

|