Насыщенные одноатомные спирты – это производные алканов, в молекулах которых один атом водорода замещён на гидроксильную группу.
Общая формула насыщенных одноатомных спиртов CnH2n+1OH. В общем виде формула однотомных спиртов R – OH, где R – алкильная группа. Кроме этого, можно использовать формулу, которая отражает молекулярный состав насыщенных одноатомных спиртов – это CnH2n+2O.
Первым представителем этого класса является метанол – СН3ОН. В состав функциональной группы спиртов входит атом кислорода, который обладает высокой электроотрицательностью, поэтому атом кислорода оттягивает на себя электронную плотность от связанных с ним атомов и получает частичный отрицательный заряд. Атом водорода и соседний от кислорода атом углерода приобретают частичные положительные заряды.
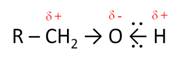
При этом связи О – Н и С – O являются полярными.
По правилам номенклатуры ИЮПАК названия насыщенных одноатомных спиртов образуются от названий соответствующих алканов с добавлением суффикса -ол.
Так, первый представитель спиртов CH3OH называется метанол, или метиловый спирт, второй представитель имеет
формулу С2Н5OH – этанол, или этиловый спирт, третий – СН3СН2СН2OH – пропанол-1, или пропиловый спирт, четвёртый представитель гомологического ряда одноатомных спиртов СН3(СН2)2СН2OH называется бутанол-1, или бутиловый спирт, пятый член этого класса соединений СН3(СН2)3СН2OH называется пентанол-1, или амиловый спирт.
При названии спиртов следует использовать правила: нумерация углеродных атомов начинается с того конца, ближе к которому расположена гидроксильная группа. Названия спиртов образуются добавлением суффикса -ол к названию соответствующего алкана, затем цифрой указывают положение гидроксильной группы.
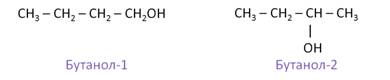
Например, назовём следующие спирты. Первый спирт называется бутанол-1, так как гидроксильная группа отходит от первого атома углерода. Второй спирт называется бутанол-2, потому что гидроксильная группа отходит от второго атома углерода.
Для того, чтобы назвать спирт с разветвлённой углеродной цепью, начинать отсчёт следует с того конца, ближе к которому расположена гидроксильная группа. Указывают положение заместителей, названия заместителей перечисляются в
алфавитном порядке и затем цифрой указывается положение гидроксильной группой.
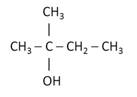
Назовём следующие спирты. У первого вещества отсчёт начинаем слева, потому что с этой стороны ближе расположена гидроксильная группа. От второго атома углерода отходит заместитель «метил». Поэтому этот спирт называется 2-метилбутанол-2.
Нумерацию у второго спирта начинаем справа, потому что с этой стороны ближе расположена гидроксильная группа, от второго атома углерода отходит заместитель «этил», а от пятого атома углерода – заместитель «метил». Поэтому полное название данного спирта будет 5-метил-2-этилгексанол-1.
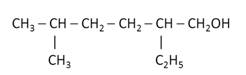
Для насыщенных однотомных спиртов характерна структурная изомерия: изомерия углеродного скелета и изомерия положения гидроксильной группы. Для метанола и этанола изомеры отсутствуют. Рассмотрим изомерию спиртов на примере вещества с формулой С4Н10О.
В зависимости от строения углеродного скелета изомерами будут бутанол-1 и 2-метилпропанол-1.
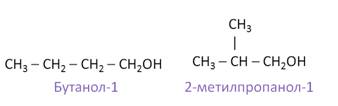
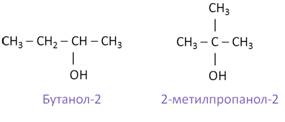
В зависимости от положения гидроксильной группы возможны ещё два изомера для вещества состава С4Н10О. Это бутанол-2 и 2-метилпропанол-2.
Спирты широко используются для различных синтезов. Во многих производствах спирты используют как растворители. Так, метанол, или метиловый спирт используется в синтезе при получении формальдегида, в производстве пластмасс, для синтеза лекарственных веществ. Метанол является хорошим растворителем.
Метанол является сильным ядом. Употребление нескольких граммов метанола приводит к слепоте, а затем к смерти.
Этанол, или этиловый спирт используется в лакокрасочной промышленности, фармацевтической промышленности, при получении взрывчатых веществ, при производстве бытовой химии, этанол применяют в кондитерском деле.
Этанол является исходным веществом в производстве диэтилового эфира, этилацетата, из этанола получают уксусную кислоту.
Спирт-ректификат – это смесь этанола и воды, в котором 4,4 % воды.
Абсолютный спирт – это безводный спирт.
Денатурат – это технический этанол, содержащий ядовитые и дурнопахнущие вещества.
Этанол оказывает негативное влияние на организм и является своего рода наркотиком. Даже небольшие дозы этанола
снижают остроту зрения, замедляют реакции и уменьшают способность здраво рассуждать.
Длительное употребление этого спирта приводит к тяжёлым заболеваниям нервной и сердечно-сосудистых систем, он разрушает печень и приводит к преждевременной смерти.
Высшие спирты используют для изготовления медицинских препаратов, в парфюмерной и косметической промышленности.
Ненасыщенный аллиловый спирт применяют в производстве глицерина, в фармацевтической и парфюмерной промышленности.
Таким образом, насыщенные одноатомные спирты – это производные алканов, в молекулах которых один атом водорода замещён на гидроксильную группу. Общая формула одноатомных спиртов СnH2n+1OH. Структурная изомерия обусловлена строением углеродного скелета и различным положением гидроксильной группы. Спирты используют для синтеза многих органических веществ.
Первые представители класса одноатомных спиртов – жидкости. Начиная со спирта, содержащего 12 и более атомов углерода – это твёрдые вещества. Газы среди спиртов отсутствуют. Низшие спирты обладают характерным алкогольным запахом, спирты, стоящие в середине гомологического ряда, имеют сильный и неприятный запах, высшие спирты, как правило, не имеют запаха.
Спирты, содержащие от одного до трёх атомов углерода, смешиваются с водой в любых соотношениях, средние спирты ограничено растворимы в воде.
С увеличением относительной молекулярной массы растворимость спиртов в воде уменьшается. Большинство спиртов растворимы в органических растворителях.
Спирты имеют более высокие температуры кипения по сравнению с алканами со схожей относительной молекулярной массой. Например, температура кипения этанола 78 0С, а пропана – -42 0С.
Высокие температуры кипения и отсутствие газов среди спиртов можно объяснить наличием межмолекулярных водородных связей. Из-за наличия у одной молекулы спирта частичного положительного заряда на атоме водорода, а на другой молекуле неподелённой пары электронов на атоме кислорода, образуются межмолекулярные водородные связи. Получается, что молекулы спиртов находятся в ассоциированном состоянии. Графически водородную связь изображают в виде трёх точек.
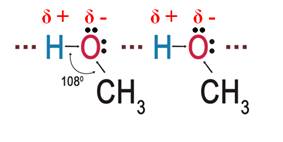
Кроме этого, образованием межмолекулярных связей между молекулами спиртов и молекулами воды, объясняется хорошая растворимость низших спиртов.
Химические свойства спиртов обусловлены также наличием в составе гидроксильных групп. Связь между атомом кислорода и водорода в гидроксильной группе сильно поляризована из-за смещения электронной плотности к кислороду. Атом водорода, при этом, становится более подвижным и легко отщепляется в виде протона. Поэтому спирты проявляют кислотные свойства. Кроме этого, из-за наличия неподелённой пары электронов на атоме кислорода, спирты проявляют свойства оснований. Таким образом, спирты являются слабыми кислотами и основаниями средней силы.
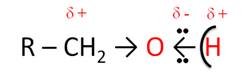
Спирты реагируют с активными металлами с образованием алкоголятов и водорода. Так, в реакции этанола с натрием образуется этанолят натрия и водород. Данная реакция относится к реакциям замещения, при этом происходит замещение атомов водорода на атомы металла.
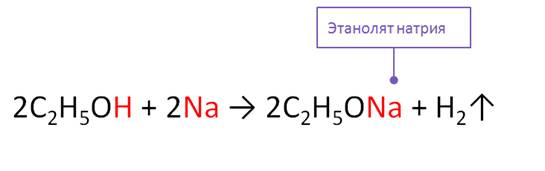
Алкоголята легко разлагаются водой. При взаимодействии этанолята натрия с водой образуется этанол и гидроксид натрия.
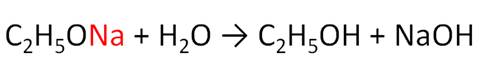
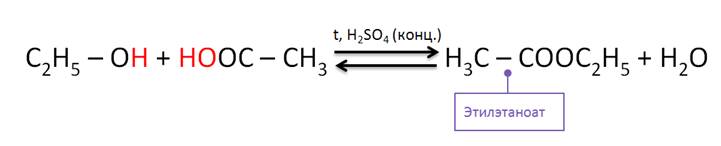
Спирты реагируют с карбоновыми и кислородсодержащими минеральными кислотами. В реакции спиртов с карбоновыми кислотами от молекулы спирта отщепляется атом водорода, а от молекулы карбоновой кислоты – гидроксильная группа. Так, в реакции этанола с уксусной кислотой образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты. Данные реакции являются обратимыми и протекают в присутствии концентрированной серной кислоты при нагревании. Реакции спиртов с карбоновыми кислотами называются реакциями этерификации.
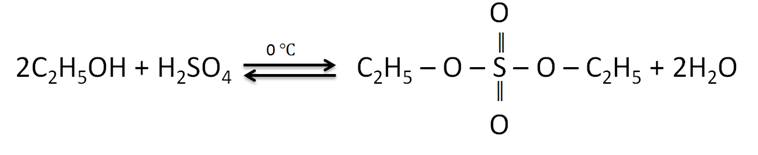
В реакциях спиртов с кислородсодержащими минеральными кислотами образуются сложные эфиры этих кислот. Так, в реакции этанола с серной кислотой образуется диэтилсульфат.
Для спиртов характерно взаимодействие с галогеноводородами с образованием галогеналканов. В этих реакциях в спиртах разрывается связь между углеводородным радикалом и гидроксильной группой. Например, в реакции этанола с бромоводородом образуется бромэтан и вода. Эта реакция является также обратимой. В этой реакции проявляются слабые основные свойства спирта.
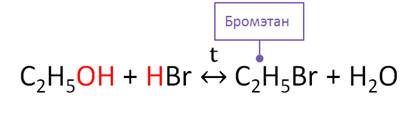
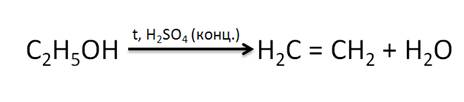
Для спиртов характерна дегидратация под действием концентрированной серной кислоты при нагревании свыше 140 0С, при этом образуются алкены. Так, в результате дегидратации этанола образуется этен.
Для спиртов характерны реакции окисления. Спирты горят на воздухе или в кислороде не коптящим пламенем с выделение большого количества теплоты. При горении этанола образуется оксид углерода (IV) и вода.
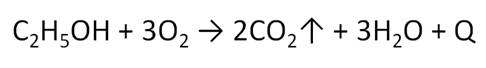
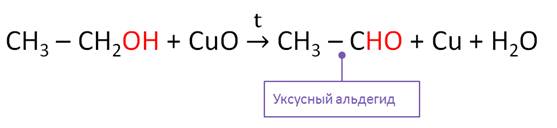
Под действием более слабых окислителей происходит частичное окисление спиртов. Если в пробирку с этанолом опустить спираль, покрытую чёрным налётом оксида меди (II), то чёрный налёт на проволоке исчезнет и в пробирке почувствуется запах образовавшегося альдегида. Так, при окислении этанола оксидом меди (II) образуется уксусный альдегид.
Рассмотрим основные способы получения спиртов. Одним из наиболее важных способов получения спиртов является гидратация алкенов. Например, этанол получают гидратацией этилена при повышенной температуре, повышенном давлении и в присутствии катализатора. Полученный таким образом этанол называют синтетическим.
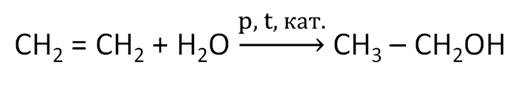
В пищевой промышленности этанол получают при спиртовом брожении глюкозы под действием ферментов. Полученный таким образом этанол используют для изготовления спиртных напитков.
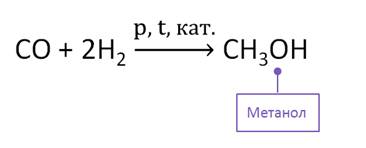
Спирты можно получить и при гидролизе моногалогеналканов с водными растворами щелочей.
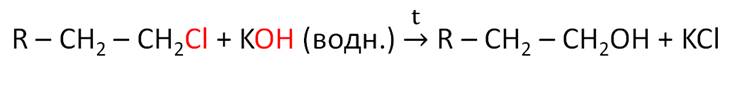
Таким образом, на физические свойства спиртов оказывает влияние водородная связь. Кислотно-основные свойства спиртов обусловлены наличием функциональной группы. Спирты взаимодействуют со щелочными металлами, галогеноводородами, карбоновыми и минеральными кислотами, вступают в реакции дегидратации и окисления. В промышленных масштабах этанол получают гидратацией этена, в процессе спиртового брожения глюкозы. Метанол получают из синтез-газа. В лаборатории спирты получают в процессе щелочного гидролиза моногалогеналканов.
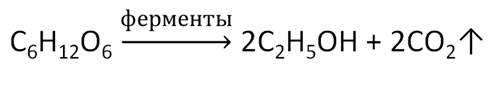
Гидролизный спирт получают из целлюлозы, которую подвергают гидролизу до образования глюкозы, которую затем подвергают брожению.
В промышленности метанол получают из синтез-газа в присутствии катализатора. |